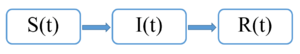Математическая модель распространения эпидемий
Содержание
Математические модели эпидемиологии — динамические системы, описывающие распространение инфекционных популяций среди здоровых.
Не все заболевания рассматриваются в рамках такого исследования: моделируются инфекции, вызываемые микропаразитами. В таком случае можно пренебречь динамикой каждого паразита (в отличие от случая макропаразитов), поскольку заболевание протекает у инфицированных с одинаковым характером. Поэтому обладания информацией о динамике здоровой популяции и заражённой достаточно для анализа модели.
Общая формулировка SIR-модели
Одна из простейших моделей распространения эпидемий — SIR-модель. Это модель ящикового вида, в которой все особи популяции разделяются на группы — "ящики", — внутри которых особи неразличимы.
В SIR-модели все особи поделены на 3 группы:
- \(S(t)\) — подверженные заболеванию особи (от англ. susceptible)
- \(I(t)\) — заражённые особи (от англ. infected)
- \(R(t)\) — переболевшие (от англ. resistant)
Важно отметить, что ящиковая модель, в том числе и SIR-модель, подразумевает собой замкнутую популяцию, в которой не происходят процессы рождаемости и смертности. Поэтому на введённые классы можно выписать ограничение\[ S + I + R = N, \]
где \( N \) — общее число особей популяции.
Замечание. Из замкнутости популяции и характера эволюции особи можно сделать вывод, что с течением времени "ящик" \(I\) заражённых особей станет пустым.
Исследование SIR-модели
Функция инфективности
Для анализа сформулированной модели вводится функция инфективности \(A(\tau)\), которая характеризует вероятность того, что произойдёт заражение индивида при контакте с заражённым индивидом \(\tau\) единиц времени назад.
В общем виде функция инфективности выглядит следующим образом:\[ A(\tau) = \begin{equation} \begin{cases} c \cdot p,\ \ t \in [T_1,\ T_2]\\ 0,\ \ \text{иначе}. \end{cases} \label{sys1} \end{equation} \]
Здесь \(p\) — вероятность заражения, а \(c\) — среднее число контактов в единицу времени. Промежуток времени \(t \in [T_1,\ T_2]\) — окно, в течение которого индивид заразен.
Таким образом, в частном случае \(A(\tau)\) можно ввести так:\[ A(\tau) = \underbrace{\beta N}_{c} \cdot \underbrace{\exp\{ -\gamma\tau \} }_{p},\ \ \beta=const>0,\]
то есть промежуток времени для заражения других особей распределен экспоненциально со средним \(\frac{1}{\gamma}\). Следовательно, средняя длина промежутка времени, в течение которого индивид заразен, равна \(\frac{1}{\gamma}\).
Замечание. Введя подобным образом функцию инфективности, получают, что число контактов растёт линейно с общим объёмом популяции \(N\), что, вообще говоря, является довольно грубым допущением. Однако оно необходимо для упрощения исследования и его наглядности.
Получение аналитического вида SIR-модели
Рассмотрим ещё одну величину \(i(t)\) — число новых заболевших в момент времени \(t\). Таким образом, \(i(t) = -\dot{S}(t)\).
При этом \(i(t)\) можно выразить через уже введённую функцию инфективности:\[i(t) = \frac{S(t)}{N} \int\limits_0^{\infty} A(\tau) i(t-\tau) d\tau.\]
Интеграл в правой части можно трактовать как среднее число "удачных" контактов (т.е. таких, при которых заражение произошло). Причём, в силу выведенной связи на \(i(t)\) и \(S(t)\) можно получить следующее:\[
\begin{equation}
\dot{S}(t) = \frac{S(t)}{N} \int\limits_0^{\infty} A(\tau) \dot{S}(t-\tau) d\tau. \label{sys2}
\end{equation}
\]
Далее вводится \(I(t)\) следующим образом:\[ I(t) = -\frac{1}{\beta} \int\limits_0^{\infty} A(\tau) \dot{S}(t-\tau) d\tau\ =\ \{s:=t-\tau\}\ =\
-\frac{1}{\beta} \int\limits_{-\infty}^t A(t-s) \dot{S}(s) ds\ =\ \{ \tau:=s\}\ =\ -\frac{1}{\beta} \int\limits_{-\infty}^t A(t-\tau) \dot{S}(\tau) d\tau.\]
С учётом того, что функция инфективности \( A(\tau) \) введена так, что \( \dot{A}(\tau) = -\gamma A(\tau)\), продифференцируем полученное равенство по параметру \(t\):\[
\dot{I}(t) = -\frac{1}{\beta} A(0) \dot{S}(t) + \frac{1}{\beta} \underbrace{A(\infty)}_{= 0}\dot{S}(-\infty) - \frac{1}{\beta} \int\limits_{-\infty}^t \left( -\gamma A(t-\tau) \dot{S}(\tau) \right) d\tau =
\]
\[
= -\frac{\beta N}{\beta}\dot{S}(t) + \gamma\cdot \underbrace{ \frac{1}{\beta} \int\limits_{-\infty}^t A(t-\tau) \dot{S}(\tau) d\tau}_{= - I(t)} = \{ \text{в силу } (\ref{sys2}) \} = \underbrace{-\frac{N S(t)}{N} \int\limits_0^{\infty} A(\tau) \dot{S}(t-\tau) d\tau}_{=\beta SI} - \gamma I(t) = \beta S(t)I(t) - \gamma I(t).
\]
Таким образом, для \(I(t)\) получается следующее уравнение динамики — \( \dot{I}(t) = \beta S(t) I(t) - \gamma I(t) = I(t) \left( \beta S(t) - \gamma \right)\).
Итоговая динамическая система, описывающая SIR-модель, выглядит следующим образом:\[
\begin{equation}
\begin{cases}
\dot{S}(t) = - \beta S(t) I(t),\\
\dot{I}(t) = I(t)\left( \beta S(t) - \gamma \right),\\
\dot{S}(t) + \dot{I}(t) + \dot{R}(t) = 0.
\end{cases} \label{sys3}
\end{equation}
\]
Последнее уравнение системы следует из её замкнутости, упомянутой выше. Причём из системы \((\ref{sys3})\) можно выразить и динамику класса переболевших — \( \dot{R}(t) = \gamma I(t)\).
Анализ SIR-модели
Исследуя полученную динамическую систему \((\ref{sys3})\) SIR-модели, можно заметить, что по переменной \(I\) существует особая точка при \(S = \frac{\gamma}{\beta} := \sigma\). При \( S(t) > \sigma\) число инфицированных растёт, и, наоборот, при \( S(t) < \sigma\) — убывает.
Однако из первого уравнения системы \((\ref{sys3})\ \ \dot{S}(t)\leqslant 0\), поэтому поведение системы разделяется на два существенно разных случая в зависимости от начального количества подверженных заболеванию \( S_0 \):
- \( S_0 < \sigma\ \Longrightarrow\) эпидемии в системе нет, поскольку число заражённых монотонно уменьшается до нуля;
- \( S_0 > \sigma\ \Longrightarrow\) происходит эпидемия в системе.

(а) В системе есть эпидемия с максимальным числом заболевших \(I_{max}\). Параметры \(\sigma = 500,\ \gamma = 5,\) \(N=1000,\ S_0=994,\ I_0=2.\)
(б) В системе не возникает эпидемия, так как \(S_0<\sigma\). Параметры \(\sigma = 800,\ \gamma = 5,\ N=1000,\ S_0=700.\)
Рассмотрим далее случай, когда в системе возникает эпидемия. Важным прикладным результатом исследования такой системы является, например, максимальное количество инфицированных, поскольку это помогает рассчитать эффективное число койко-мест в больницах во время пика эпидемии. На рис. 2 (а) можно наблюдать этот пик, обозначенный за \(I_{max}\). Можно найти его значение аналитически, исследовав \(\frac{dI}{dS}\):\[
\frac{dI}{dS} = \frac{\beta SI - \gamma I}{-\beta SI} = -1 + \frac{\sigma}{S}\ \ \Longrightarrow\ \ I+S-\sigma\ln S = const.
\]
Последнее выражение является первым интегралом системы \((\ref{sys3})\), поэтому, учитывая начальные условия \(S(0) = S_0,\ I(0) = I_0\), получается следующее:\[
I + S - \sigma\ln S = I_0 + S_0 - \sigma\ln S_0\ \ \Longrightarrow\ \ I_{max} = I_0 + S_0 - \sigma - \sigma \ln \frac{S_0}{\sigma}.
\]
Помимо максимального числа заражённых полезно знать количество особей, так и не переболевших за всё время эпидемии. Для этого рассматривается отношение \(\frac{dS}{dR}\):\[
\frac{dS}{dR} = \frac{-\beta SI}{\gamma I} = -\frac{1}{\gamma}S\ \ \Longrightarrow\ \ \sigma\frac{dS}{S}=-dR\ \ \Longrightarrow\ \ \sigma \ln |S| = -R+C\ \ \Longrightarrow\ \ S(t)=C_0 \exp \{-\sigma R\}.
\]
Как уже было замечено выше, в силу замкнутости популяции \(I(t)\xrightarrow[t\to\infty]{} 0\ \ \Longrightarrow\ \ S(\infty) + R(\infty) = N.\)
Тогда можно составить трансцендентное уравнение:\[S(\infty) = C_0 \exp \left\{ \frac{S(\infty)-N}{\sigma} \right\},\] у которого существует единственное решение, и оно положительно. На рис. 2 можно наблюдать, что со временем количество так и не переболевших особей \(S(\infty)\) действительно стабилизируется.
Формулировка SEIR-модели
Существуют более продвинутые модели, учитывающие различные аспекты протекания болезни. Например, SEIR-модель включает в себя новый, четвёртый ящик \(E(t)\) — особи, находящиеся в латентном периоде заболевания, то есть уже заболевшие, но ещё не заразные (англ. exposed).
Описывающая такую динамику система выглядит следующим образом:\[ \begin{equation} \begin{cases} \dot{S}(t) = - \beta S(t) I(t),\\ \dot{E}(t) = \beta S(t) I(t) - \alpha E(t),\\ \dot{I}(t) = \alpha E(t) - \gamma I(t),\\ \dot{R}(t) = \gamma I(t). \end{cases} \end{equation} \]
Список литературы
- Абрамова В.В. "Лекции по прикладным задачам системного анализа: задачам биоматематики", 2024.
- Братусь А.С., Новожилов А.С., Платонов А.П. "Динамические системы и модели биологии", 2011.